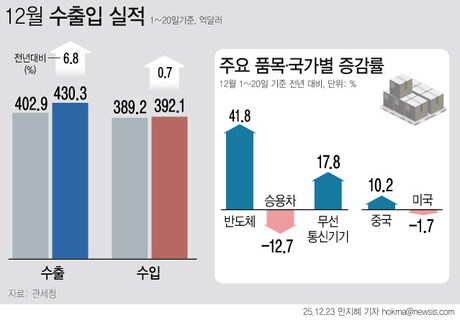
|
| ▲삼성바이오에피스 전경. 사진=삼성바이오에피스 |
[CWN 최한결 기자] 삼성바이오에피스는 유럽연합 집행위원회(EC)로부터 스텔라라 바이오시밀러 피즈치바의 품목허가를 최종 획득했다고 23일 밝혔다.
이로써 피즈치바는 지난 2월 유럽 의약품청 산하 약물사용 자문 위원회로부터 품목 허가 긍정의견을 받은 이후 2개월 만에 최종 품목 허가가 이뤄졌다.
피즈치바의 오리지널 의약품인 스텔라라는 미국 얀센이 개발한 판상 건선, 건선성 관절염, 크론병, 궤양성 대장염 등에 처방되는 자가면역질환 치료제다.
면역반응에 관련된 염증성 사이토카인의 한 종류인 인터루킨(IL)-12, 23의 활성을 억제하며 연간 글로벌 매출 규모는 약 14조원(108억5800만달러)에 달한다.
스텔라라 바이오시밀러는 앞서 미국에서 암젠, 알보텍이 허가를 받았고 유럽에선 알보텍이 올해 1월 허가받은 바 있다. 국내에선 삼성바이오에피스가 지난 11일 처음으로 스텔라라 바이오시밀러 허가를 획득했다.
삼성바이오에피스는 지난해 9월 글로벌 제약사 산도스와 피즈치바의 유럽 및 북미 판매를 위한 파트너십 계약을 체결, 향후 유럽 시장에서 산도스가 판매할 예정이다.
정병인 삼성바이오에피스 RA팀장은 “앞으로도 다양한 자가면역질환 치료제 확보와 의약품 개발을 통해 환자들에게 더 많은 치료 옵션을 제공할 수 있도록 노력하겠다”고 전했다.
CWN 최한결 기자
hanbest0615@cwn.kr
[저작권자ⓒ CWN(CHANGE WITH NEWS). 무단전재-재배포 금지]
























![[신명호 칼럼] 우리에게는 역사철학이 필요하다](/news/data/2025/12/02/p1065588394134060_370_h.png)
![[구혜영 칼럼] 마음먹은 만큼 행복하다](/news/data/2025/12/01/p1065588186525220_542_h.png)

![[윤창원 칼럼] 난경(難境)이 곧 시경(試境)](/news/data/2025/11/28/p1065571403155795_758_h.png)